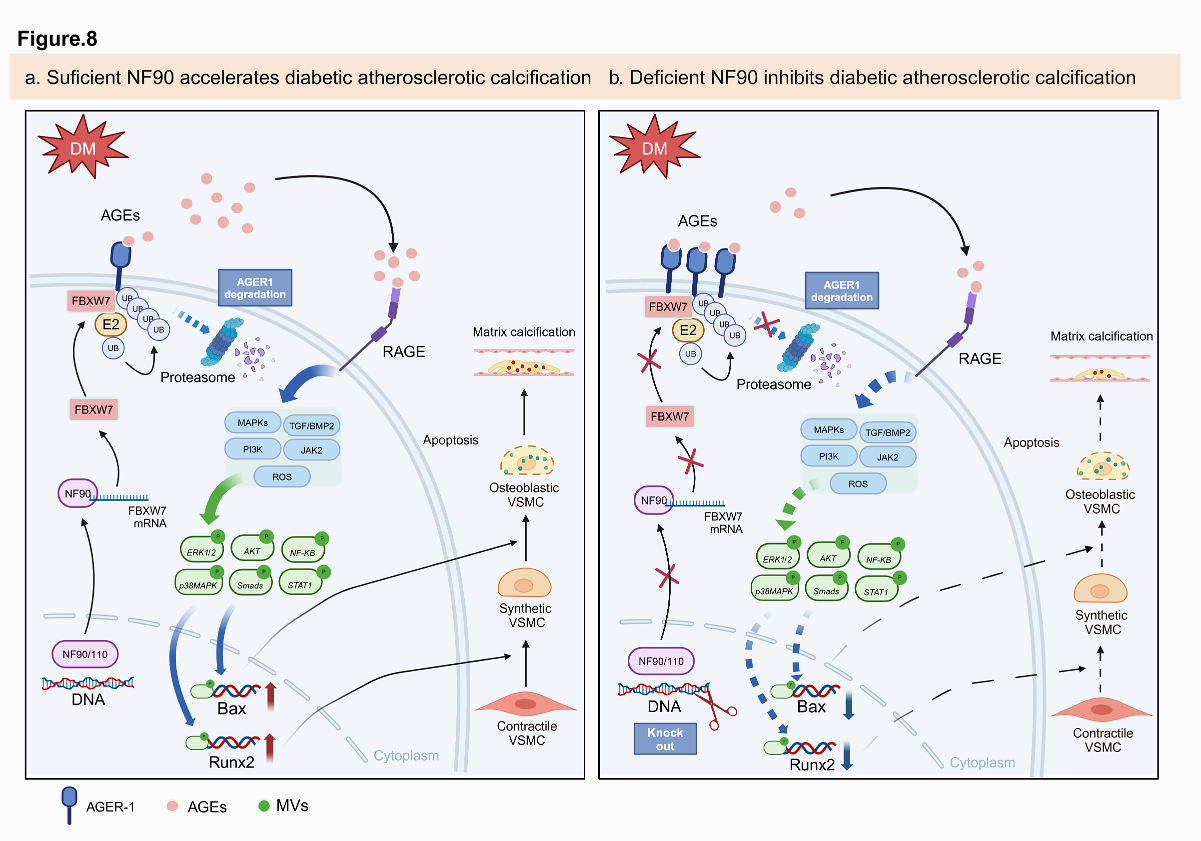
血管鈣化是常見的糖尿病血管并發癥,是導致糖尿病患者死亡、卒中和下肢截肢的重要因素,但血管鈣化的機制不明,缺乏有效的干預靶點和治療方法。以往研究提示,持續的高血糖可導致體內糖基化終末產物(AGEs)增加,后者通過AGEs受體促進血管鈣化的發生和發展。然而,糖尿病導致AGEs積累的機制未明。白細胞介素增強子結合因子3(ILF3)是一種雙鏈RNA結合蛋白,包括NF90和NF110兩種亞型,參與調節DNA的轉錄、翻譯、mRNA的穩定性和非編碼RNA的生物合成。大型隊列研究發現,ILF3和心血管疾病相關,但ILF3和糖尿病血管鈣化之間的關系不明。
在張運院士指導下,齊魯醫院心內科和急診科研究團隊密切合作,發現在糖尿病患者和糖尿病血管鈣化小鼠模型中,平滑肌細胞(VSMC)中的ILF3的NF90亞型表達上調,平滑肌細胞中AGEs水平上升,增多的AGEs作用于特異性受體RAGE,激活多條下游信號通路,促進VSMC的表型轉化和凋亡以及基質囊泡的釋放,最終加速糖尿病血管鈣化的發生與發展。深入研究發現,NF90的激活可通過增強泛素化蛋白酶FBXW7mRNA的穩定性并上調其表達,引發AGEs的清除受體AGER1(負責清除體內AGEs的主要受體蛋白)的泛素化和蛋白酶體降解,導致AGEs細胞內的清除受阻和快速積累,最終加速糖尿病血管鈣化的發生。相反,VSMC特異性敲除NF90后,FBXW7表達下調,AGER1蛋白水平升高,AGEs在細胞內的積累減少,糖尿病血管鈣化受到顯著抑制。隨后,課題組利用敲除FBXW7的補救實驗證實了NF90通過FBXW7-AGER1-AGEs通路介導糖尿病血管鈣化的分子機制,為糖尿病血管鈣化提供了新的干預靶點。該研究近日發表于Nature Communications,齊魯醫院心血管實驗室張銘湘教授、急診科陳玉國教授和心內科張運院士為該文的共同通訊作者,齊魯醫院急診科博士后謝飛博士、劉斌博士和心內科喬溫博士為該文的共同第一作者,山東大學齊魯醫院為該文的第一和通訊作者單位。
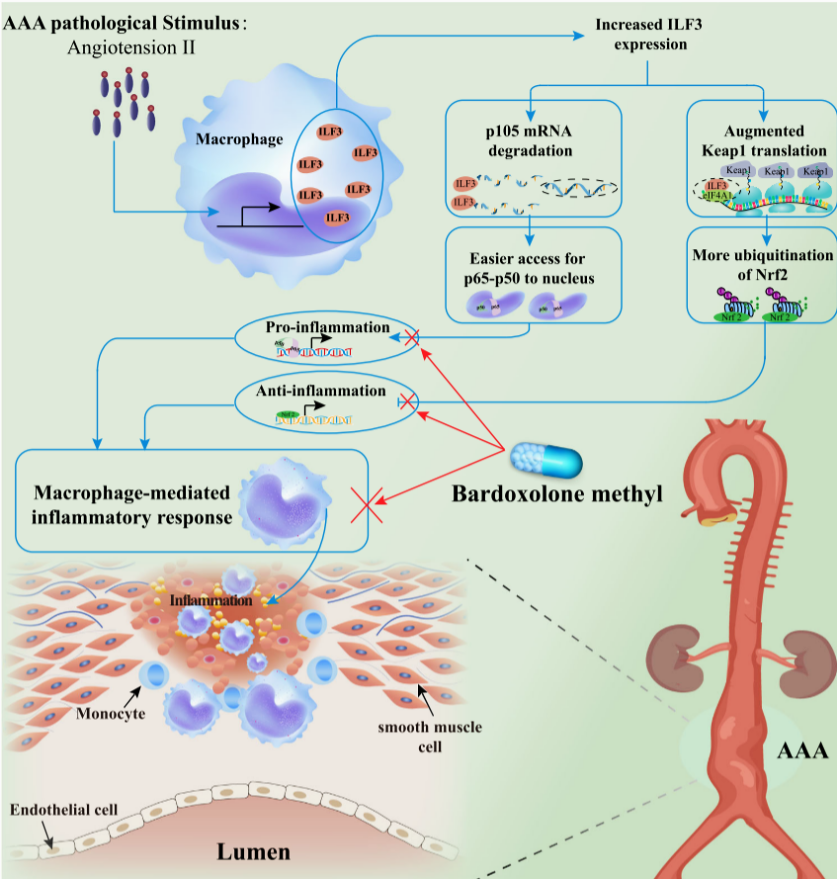
腹主動脈瘤(Abdominalaorticaneurysm,AAA)是一種嚴重的大血管疾病,一旦破裂,死亡率超過80%。AAA的病理特征是主動脈的不可逆性擴張,伴有管壁炎癥、蛋白水解活性增強和細胞外基質降解。近年研究表明,促炎和抗炎反應之間的不平衡在AAA的發展中起著關鍵作用。然而,AAA的發病機制不明,治療藥物欠缺。
白細胞介素增強結合因子3(ILF3)作為一種雙鏈RNA結合蛋白,是已知的先天性免疫反應的調節劑,與心血管疾病密切相關,但ILF3在AAA中的作用和機制不明。齊魯醫院心內科張銘湘教授課題組研究發現,在AAA患者和血管緊張素II(AngII)誘導的AAA小鼠模型中,ILF3表達水平明顯升高,且主要在巨噬細胞中表達。因此,該課題組構建了巨噬細胞特異性ILF3過表達小鼠(ILF3M-Tg)和巨噬細胞特異性ILF3敲除小鼠(ILF3M-KO),在AngII和CaCl2誘導的AAA小鼠模型中,發現巨噬細胞ILF3敲除顯著減輕了AAA進展,而巨噬細胞ILF3過表達則加重AAA進展。為進一步闡明巨噬細胞ILF3在AAA發病中的作用和機制,課題組通過scRNA-seq,發現巨噬細胞ILF3與免疫應答相關的信號通路顯著相關。深入研究發現,巨噬細胞ILF3通過調控NF-κB和Keap1-Nrf2途徑,導致巨噬細胞中促炎與抗炎反應的失衡,進而介導了AAA的發生。
目前,AAA的治療主要以外科手術為主,缺乏針對性藥物,單純的抗炎藥物療效不佳。甲基巴多索隆(BM)已被證明是Keap1-Nrf2通路的激活劑和NF-κB途徑的抑制劑。課題組利用BM治療AAA,發現BM可逆轉巨噬細胞ILF3過表達所引起的血管擴張,有望成為治療AAA的有效藥物。總之,該研究發現了巨噬細胞ILF3在AAA中的重要作用和機制,為AAA的干預提供了新靶點和新藥物。該研究近日發表于Nature子刊Nature Communications,齊魯醫院心血管實驗室張銘湘教授、急診科陳玉國教授、心內科張運院士和首都醫科大學安貞醫院心內科姜文劍教授為該文的共同通訊作者,齊魯醫院心內科博士生王朝陽(現為山東省立醫院心內科醫師)和程杰為該文的共同第一作者,山東大學齊魯醫院為該文的第一和通訊作者單位。
射血分數保留性心力衰竭(HFpEF)是心力衰竭的一種亞型,其特征是左室射血分數正常,但左室舒張功能受損,導致心臟在舒張期充盈受損和收縮期射血減少。隨著全球老齡化趨勢的加劇,HFpEF的發病率逐年上升,但臨床治療手段受限。血管內皮功能異常是眾多心血管疾病的始動因素,心臟中內皮細胞數目約占總細胞數目的45%,因此靶向心臟內皮細胞有可能成為治療HFpEF的潛在途徑。本課題組前期研究發現,他汀類藥物可通過miR-133a/GTPCH1途徑改善多種環境危險因素所引起的血管內皮功能異常(Circulation,2016,29;134(22):1752-1765),但他汀對HFpEF的作用不明。齊魯醫院王雙喜教授領導的課題組采用生物信息學、分子生物學、細胞生物學和模式動物學等多項實驗手段,發現洛伐他汀在心臟血管內皮細胞(主要是心內膜內皮細胞和冠脈微循環內皮細胞)通過激活轉錄因子AP-2α上調circRNA-RBCK1的表達。深入研究發現,circRNA-RBCK1通過海綿吸附效應抑制miR-133a的功能,從而增加GTPCH1基因的表達。在代謝異常和血流動力學異常雙重因素所誘發的HFpEF小鼠模型中,洛伐他汀改善了左室的舒張功能,該效應可被內皮特異性敲除AP-2α或沉默circRNA-RBCK1所阻斷。總之,該研究揭示了他汀類藥物可通過靶向心臟內皮細胞AP-2α/circRNA-RBCK1/miR-133a/GTPCH1途徑改善左室的內皮依賴性舒張功能,為HFpEF的防治研究提供了新思路。該研究近日發表于Nature子刊Nature Communications,齊魯醫院心血管實驗室王雙喜教授、新鄉醫學院李鵬教授和山東省立醫院心內科董波教授為該文的共同通訊作者,齊魯醫院心血管實驗室李彬博士、中醫科白文武副教授和心內科郭濤副教授為該文的共同第一作者,山東大學齊魯醫院為該文的第一和通訊作者單位。





