
Seeker System
近日,美國食品和藥品監督管理局(FDA)批準了針對新生兒罕見溶酶體儲存紊亂(LSDs)的尋求者系統(Seeker System)上市,可以用于4種新生兒罕見代謝疾病的篩查,分別是檢測粘多糖病(Mucopolysaccharidosis)類型I (MPS I)、龐貝氏癥(Pompe)、高雪氏癥(Gaucher)和法布里病(Fabry)。
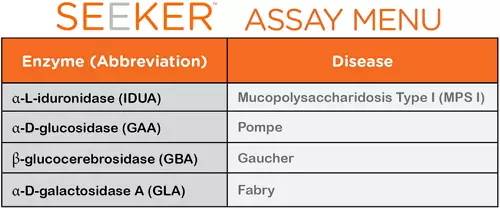
據悉,Seeker System由北卡羅來納州 Durham的Baebies公司制造,由Seeker LSD試劑盒- IDUA|GAA|GBA|GLA和Seeker 儀器組成,是首個被FDA批準允許上市進行上述遺傳性疾病的新生兒篩查測試。
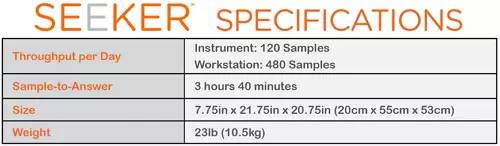
如圖所示,Seeker System平臺每日的吞吐量為120個樣本/儀器,480個樣本/工作站,樣本響應時間為3小時40分鐘,樣品是取自出生24到48小時的新生兒的腳后跟。
根據FDA官網的報道:罕見溶酶體儲存紊亂(LSDs)是一組罕見的遺傳代謝疾病,其中在機體細胞中正常消除卻不需要底物的酶(蛋白)會呈現非正常水平或功能不當。
根據美國衛生和人類服務部咨詢委員會( U.S. Department of Health and Human Services’ Advisory Committee,HHS)對新生兒和兒童遺傳性疾病( Heritable Disorders)、MPS I,龐貝氏癥、高雪氏癥和法布里病的定義,他們在新生兒和兒童身上的發病率發生約在1/185000到1/1500 之間。如果沒有及時被檢測到并進行治療,這些遺傳性疾病可能至器官損傷、神經學殘疾甚至死亡。
FDA設備與放射衛生中心體外診斷和放射衛生辦公室主任Alberto Gutierrez博士表示,美國衛生和人類服務部咨詢委員會的秘書最近將龐貝氏癥和MPS I加入至建議新生兒常規篩查程序清單,預計將被要求使用篩查測試檢測這些疾病,準確的篩查測試將有助于在新生兒中發生損傷前提早檢測、治療和控制。這是為什么評估LSD篩查方法的可供利用性、準確性和可靠性對FDA是如此重要。
據了解,目前被授權在所有新生兒中進行LSD篩查的州包括亞利桑那(Arizona)、伊利諾伊(Illinois)、肯塔基(Kentucky)、密歇根(Michigan)、密蘇里(Missouri)、新澤西(New Jersey)、新墨西哥(New Mexico)、紐約(New York)、俄亥俄(Ohio)、賓夕法尼亞(Pennsylvania)和田納西(Tennessee)。
此外,FDA還表示審評Seeker系統的數據是通過從頭開始上市(de novo premarket review pathway)前審評途徑,這是對新型中低度風險醫療器械的一種監管途徑。實質上,它不同于一種早已合法上市的醫療器械,也不同于進一步開發特異性控制以提供一個裝置安全性和有效性的合理保障。
Seeker System通過測量干血樣品中對健康溶酶體貯存要求的蛋白的活性水平工作。被藥盒檢測到的四個LSDs關聯任何一種蛋白的酶活性減低,表明一種疾病可能存在。在監管過程中,FDA評價了來自密蘇里154412名新生兒臨床研究數據,他們的干血樣品被用于測試MPS I、龐貝氏癥、高雪氏癥和法布里病關聯蛋白活性。由于該系統可以準確鑒定被篩查的73例患有四種LSDs至少一種的新生兒且研究或自始至終無假陰性結果,因此FDA認定該系統是有效的。
Seeker System由來自美國健康的尤尼斯肯尼迪施萊弗國家研究所(Health’s Eunice Kennedy Shriver National Institute)的兒童衛生和人發展(Child Health and Human Development)的小企業創新研究計劃提供的資金開發。





